

guide of issue 2
導讀
目前國際治療指引普遍建議,使用氫離子幫浦阻斷劑(PPIs)做為治療胃食道逆流疾病(GERD)病人的標準藥物;然而,PPIs 的療效並不能完全達成 GERD 病人所需要的糜爛性食道炎(EE)癒合及避免復發,特別是夜間未能服藥而出現的 GERD 症狀更深深影響了病人的生活品質。在已知胃內環境 pH 值與 EE 癒合之間具高度關聯性的前提下,如何減少夜間發作正是此文要討論的重點。
EE 症狀緩解的關鍵正是每日胃內環境 pH 值大於 4 的時間比率!
EE 症狀緩解的關鍵正是每日胃內環境 pH 值大於 4 的時間比率!
從整體治療的觀點來看,GERD 的治療除了症狀控制與改善生活品質外,如何促成 EE 癒合與降低復發可能性也很重要。而 EE 症狀緩解甚至達到所謂癒合的關鍵正是每日胃內環境 pH 值大於 4 的時間比率,佔 24 小時的比率愈高,EE 癒合情況就愈好1。
目前 GERD 治療的標準藥物 PPIs 對病人而言,在服藥的第 1 天藥物制酸的效果還不到一半,約在 24~43% 間而已,且需連續用藥 3~5 天,才能發揮最大制酸作用。也因此,當藥物穩定制酸的效果越慢達成,GERD 病人所能感受到的症狀緩解效果也就越晚出現。此外,傳統 PPIs 的半衰期相當短,僅有 1 ~ 2 小時2,無法 24 小時長時間維持胃內環境 pH 值大於 43。當病人夜間休息時,因藥物效用減退或其他原因造成胃內環境 pH 值小於 4 之狀態持續長達 60 分鐘以上時,即是所謂的夜間酸突破(NAB)現象4,5。

傳統 PPIs 半衰期僅約 1 ~ 2 小時
無法 24 小時穩定維持胃內環境 PH 值
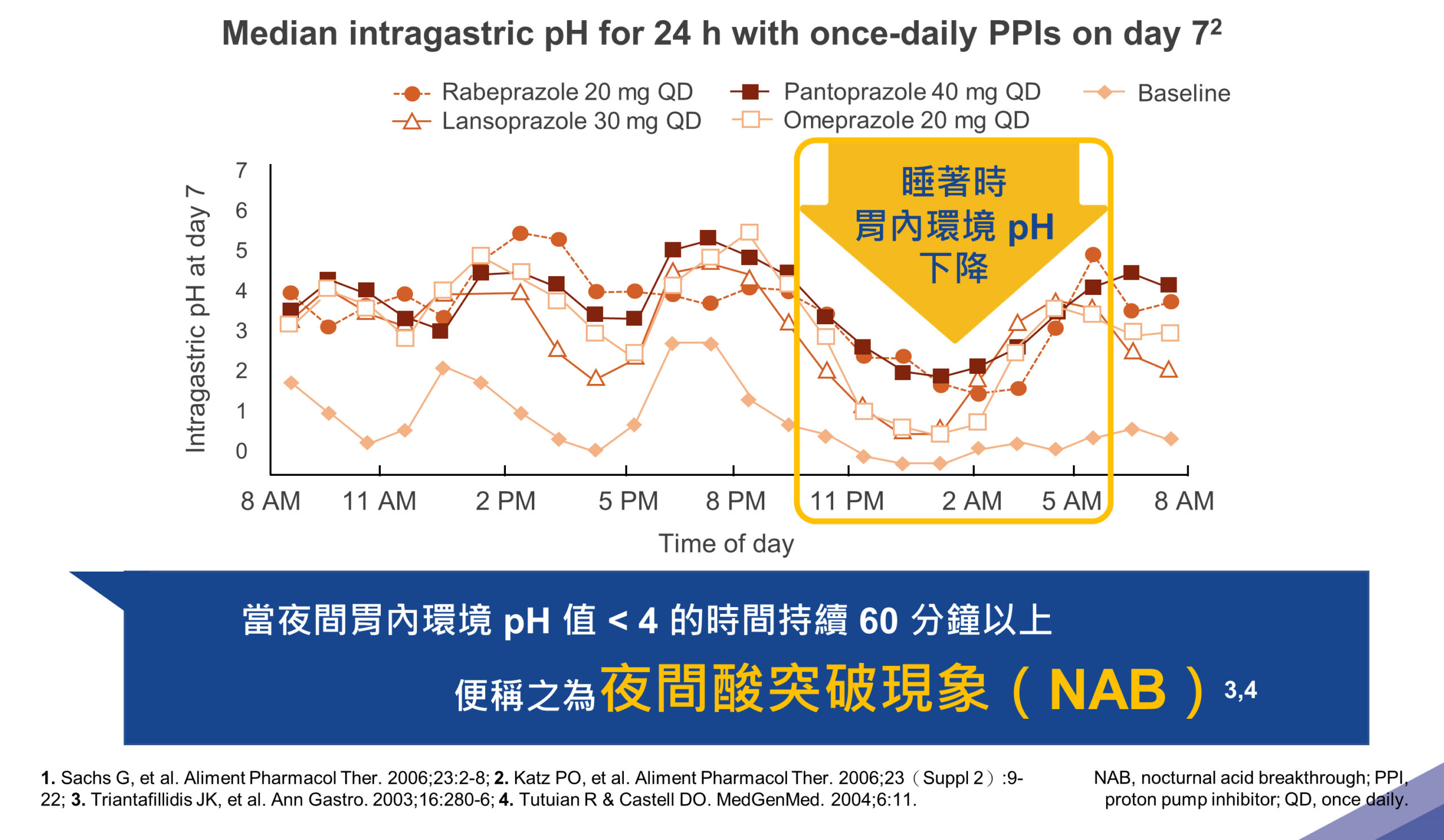
根據統計數據顯示,每週至少發生 2 次心灼熱事件的 GERD 病人中,將近八成會有夜間症狀,也就是 NAB;且其中 75% 的病人睡眠因此受到影響,六成左右的病人認為睡不好正是心灼熱症狀所造成的,甚至有 40% 的病人隔天因為睡眠所受的干擾而無法有效率的執行日常活動6。有鑑於此,新一代的 PPI — Dexilant,透過 dual-delayed release 技術,在持續治療的第 5 天時,可使胃內環境 pH 值大於 4 的時間延長至將近 17 個小時7。新一代的 PPI(Dexilant)的效果已較傳統 PPIs 來得佳,往理想 EE 癒合所需的時間比率更邁進一步。

即使接受 PPls 的治療
仍有約 45% 的病人持續出現夜間症狀
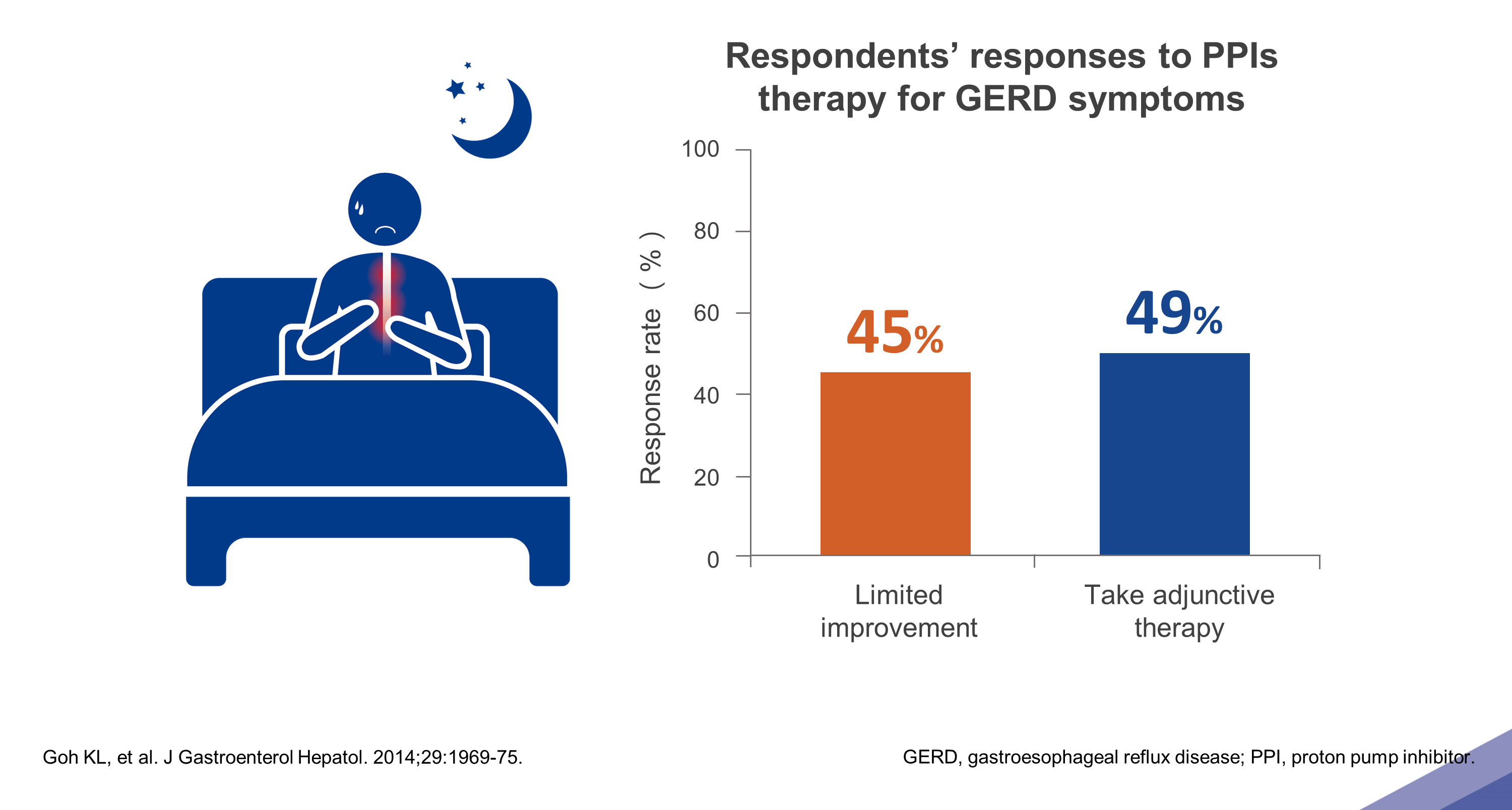
然而,即使接受了 PPIs 治療,仍有約 45% 的 GERD 病人覺得改善有限,仍受夜間症狀所困擾,且半數病人需要使用其他輔助療法才能達到緩解的效果8。就目前臨床上 GERD 的標準藥物治療而言,尚無法達到 GERD 病人所需要的迅速症狀緩解,或是長時間穩定控制胃內環境 pH 值從而避免夜間症狀的發生等需求;因此,尋求對 GERD 病人更有幫助的治療方式,以減少 NAB 的發生風險,同時改善病人的生活品質與避免復發,是目前值得深入探討的目標。

傳統 PPIs 半衰期僅約 1~2 小時
無法 24 小時穩定維持
胃內環境 pH 值

根據統計數據顯示,每週至少發生 2 次心灼熱事件的 GERD 病人中,將近八成會有夜間症狀,也就是 NAB;且其中 75% 的病人睡眠因此受到影響,六成左右的病人認為睡不好正是心灼熱症狀所造成的,甚至有 40% 的病人隔天因為睡眠所受的干擾而無法有效率的執行日常活動6。有鑑於此,新一代的 PPI — Dexilant,透過 dual-delayed release 技術,在持續治療的第 5 天時,可使胃內環境 pH 值大於 4 的時間延長至將近 17 個小時7。新一代的 PPI(Dexilant)的效果已較傳統 PPIs 來得佳,往理想 EE 癒合所需的時間比率更邁進一步。

即使接受 PPLs 的治療
仍有約 45% 的病人持續出現夜間症狀

然而,即使接受了 PPIs 治療,仍有約 45% 的 GERD 病人覺得改善有限,仍受夜間症狀所困擾,且半數病人需要使用其他輔助療法才能達到緩解的效果8。就目前臨床上 GERD 的標準藥物治療而言,尚無法達到 GERD 病人所需要的迅速症狀緩解,或是長時間穩定控制胃內環境 pH 值從而避免夜間症狀的發生等需求;因此,尋求對 GERD 病人更有幫助的治療方式,以減少 NAB 的發生風險,同時改善病人的生活品質與避免復發,是目前值得深入探討的目標。
縮寫:EE, erosive esophagitis; GERD, gastroesophageal reflux disease; NAB, nocturnal acid breakthrough; PPI, proton pump inhibitor.
References: 1. Bell NJ, et al. Digestion. 1992;51(Suppl 1):59-67; 2. Sachs G, et al. Aliment Pharmacol Ther. 2006;23(Suppl 2):2-8; 3. Kirchheiner J, et al. Eur J Clin Pharmacol. 2009;65:19-31; 4. Triantafillidis JK, et al. Ann Gastro. 2003;16:280-6; 5. Tutuian R & Castell DO. MedGenMed. 2004;6:11; 6. Lim KG, et al. Chest. 2018;154:963-71; 7. Vakily M, et al. Curr Med Res Opin. 2009;25:627-38; 8. Goh KL, et al. J Gastroenterol Hepatol. 2014;29:1969-75.
得喜胃通 60 毫克緩釋膠囊 (衛署藥輸字第 025887 號)
Dexilant Delayed Release Capsules 60 mg
主要成分:Each capsule contains Dexlansoprazole 60 mg
藥商名稱:台灣武田藥品工業股份有限公司
藥商地址:台北市信義區松高路 1 號 17 樓
【處方資訊摘要】
適應症:治療糜爛性食道炎:可使用得喜胃通治療各種等級的糜爛性食道炎(EE)於含 12 歲以上病患,使用達8週。維持糜爛性食道炎已治癒後的療效:可使用得喜胃通維持已治癒EE的療效及緩解心灼熱於含 12 歲以上病患,於成人使用達 6 個月、12~17 歲使用達 16 週。非糜爛性胃食道逆流疾病之症狀治療:可使用得喜胃通治療有症狀的非糜爛性胃食道逆流疾病(GERD)所引起的心灼熱於含12歲以上病患,持續 4 週。
用法用量:得喜胃通依適應症於含 12 歲以上病患之用藥建議:治療糜爛性食道炎(EE),每天一次 60 mg。維持已治癒糜爛性食道炎(EE)的療效及緩解心灼熱,每天一次 30 mg。非糜爛性胃食道逆流疾病(GERD)之症狀治療,每天一次 30 mg。
肝功能不全患者治療糜爛性食道炎(EE)的劑量調整:中度肝功能不全(Child-Pugh 分級 B)的患者,每天最高劑量為 30 mg 治療 8 週。重度肝功能不全(Child-Pugh 分級 C)的患者不建議使用本品。
得喜胃通可與食物併服,亦可不與食物併服。得喜胃通必須整粒吞服。請勿咀嚼得喜胃通。
禁忌症:若已知患者對得喜胃通配方內的任何成分過敏,則禁止服用。已有病例報告,使用得喜胃通後發生過敏及嚴重過敏性反應(anaphylaxis)。於其他的質子幫浦抑制劑(PPIs)包括 Lansoprazole 會有急性間質性腎炎的案例報告。質子幫浦抑制劑(PPIs)包括得喜胃通,與含 rilpivirine 藥物為禁忌。
警語及注意事項:胃癌:於成人服用得喜胃通所得的療效,無法排除胃癌存在的可能性。急性間質性腎炎:PPI 包含 Lansoprazole 治療的病患曾觀察到急性間質性腎炎。如果發生急性間質性腎炎,須停止以得喜胃通治療。困難梭狀桿菌相關腹瀉:PPI 類產品的治療可能增加困難梭狀桿菌相關腹瀉的風險,尤其是在住院的病人。當腹瀉情形未有改善時,應考慮為此診斷。應採用適合患者病況的 PPI 治療,並使用最低的劑量及最短的治療期間。骨折:幾項已發表的觀察性試驗指出,PPI 治療可能提高骨質疏鬆的發生風險,造成髖骨、腕骨或脊椎的骨折。接受高劑量(定義為每天多次用藥)的長期(1 年或更久)PPI 治療,會使患者發生骨折的風險增高。應採用適合患者病況的 PPI 治療,並使用最低的劑量及最短的治療期間。皮膚及全身性紅斑狼瘡:於服用PPI的患者曾有皮膚紅斑狼瘡(CLE)和全身性紅斑狼瘡(SLE)報告。這些事件發生於新發病與現有自身免疫疾病的惡化。避免服用 PPI 長於醫生指示的時間。若注意到使用 DEXILANT 的患者發生與皮膚紅斑狼瘡(CLE)或全身性紅斑狼瘡(SLE)相符的徵兆或症狀,請停止服用該藥物,並將患者轉診給相關的專家進行評估。氰鈷胺(維生素 B12)缺乏症:長期每日以任何制酸藥物治療(例如,超過 3 年以上)可能因胃酸減少或缺乏而導致氰鈷胺素(維生素 B12)的吸收障礙。如果臨床上觀察到與氰鈷胺缺乏相同的症狀應該考量這個診斷。低鎂血症:使用 PPI 治療至少三個月的患者很少出現有症狀或無症狀的低鎂血症;大多數的出現低鎂血症的患者為使用PPI治療一年以上。嚴重不良事件包括肌肉強直,心律不整及癲癇發作(seizure)。大多數的病人需補充鎂離子並停止使用 PPI 來治療低鎂血症。若預期病人將延長治療時間或併用例如 Digoxin 或其他可能造成低鎂血症的藥物(例如利尿劑),則醫療專業人員應考慮在開始PPI治療前以及後續定期監測鎂離子的濃度。與神經內分泌腫瘤研究的交互作用:血清嗜鉻粒蛋白 A (CgA)濃度增加繼發於藥物引起的胃酸減少。血清嗜鉻粒蛋白 A (CgA)濃度的增加可能導致神經內分泌腫瘤診斷檢驗為陽性的結果。醫療保健機構在評估 CgA 濃度前應暫時停止以 dexlansoprazole 治療至少 14 天並且若最初測得的 CgA 濃度較高應考慮再檢測。如果執行連續的測試,應於相同的檢驗室檢測,因各檢測間之參考的範圍可能會不同。得喜胃通與 methotrexate 的併用:有文獻顯示 PPI 併用 methotrexate(高劑量主要使用於腫瘤病人)可能增加及延長 methotrexate 的血清濃度及/或代謝,有可能造成 methotrexate 的毒性。當使用高劑量 methotrexate 時,應考慮有些病人可能需要暫時停止使用 PPI 類藥品。
不良反應:成人對照臨床試驗的常見不良反應:腹瀉、腹痛、噁心、上呼吸道感染、嘔吐、腸胃脹氣。以下的嚴重不良反應會說明於下及仿單其他章節:急性間質性腎炎、困難梭狀桿菌相關腹瀉、骨折、皮膚及全身性紅斑狼瘡、氰鈷胺(維生素B12)缺乏症、低鎂血症。
仿單版本:201707
<詳細內容請參閱本品核定仿單>

福星定膜衣錠 20 毫克(衛部藥輸字第 027623 號)
Vocinti Film-Coated Tablets 20 mg
主要成分:
Each tablet containing Vonoprazan Fumarate 26.72mg (as the free base 20mg)
藥商名稱:台灣武田藥品工業股份有限公司
藥商地址:台北市信義區松高路1號17樓
【處方資訊摘要】
適應症:糜爛性食道炎(EE)的治療及維持治療。治療胃潰瘍。治療十二指腸潰瘍。輔助根除幽門螺旋桿菌(Helicobacter pylori)。
用法用量:糜爛性食道炎-對於糜爛性食道炎的治療,成人每日口服劑量為vonoprazan 20mg,每日一次,服藥期間通常不超過4週。然而,當療效不完全時,可給藥最多達8週。對於糜爛性食道炎癒合療效之維持治療,每日口服劑量為10mg,每日給藥一次,然而,若效果不充分,則口服劑量可增加至20mg,每日給藥一次。目前臨床試驗中vonoprazan用於糜爛性食道炎維持治療的療效安全性資料最多為一年。胃潰瘍、十二指腸潰瘍¬-一般而言,成人每日口服劑量為vonoprazan 20mg,每日一次。針對胃潰瘍治療,服藥期間通常不超過8週,針對十二指腸潰瘍,通常不超過6週。
輔助根除幽門螺旋桿菌-一般而言,成人每天2次於相同時間口服下列三種藥物:vonoprazan 20mg/次、amoxicillin 750mg/次以及clarithromycin 200-400mg/次,使用7天。當質子幫浦抑制劑、amoxicillin及clarithromycin 3種藥物組合用於幽門螺旋桿菌根除治療失敗時,可使用下列3種藥物作為替代治療:通常成人每天2次於相同時間口服3種藥品:vonoprazan 20mg/次、amoxicillin 750mg/次、metronidazole 250mg/次,使用7天。
中、重度肝功能不全或重度腎功能不全病人不建議使用。
禁忌症:福星定禁止用於下列病人:1.對本藥主成分或任何賦形劑曾有過敏史之病人。2.正在接受atazanavir sulfate或rilpivirine hydrochloride治療的病人。
警語及注意事項:肝毒性:建議適時檢測肝功能。胃酸pH值升高:vonoprazan會使胃酸pH升高,因此不建議與吸收會受胃酸pH值所影響的藥物一起併用。Vonoprazan的療效反應,無法排除惡性胃部腫瘤存在的可能性。
特殊族群:有肝、腎疾病的病人應小心使用,因肝、腎功能不全有可能因福星定的延遲代謝及排泄,而導致vonoprazan血中濃度上升;中、重度肝功能或重度腎功能不全病人不建議使用福星定膜衣錠20mg,每天2次,因尚未在此類病人評估其安全性。老年病人。
服用福星定膜衣錠有可能會遮蔽胃癌症狀。
研究報導指出,接受氫離子幫浦阻斷劑治療會增加與骨質疏症相關之髖部、手腕或脊椎的骨折風險。
合併使用福星定膜衣錠及抗生素用於幽門螺旋桿菌根持治療時,可能造成偽膜性腸炎,若有發生腹痛且經常性腹瀉,應採取適當措施。
不良反應:胃潰瘍、十二指腸潰瘍、糜爛性食道炎臨床試驗觀察到之不良反應:胃腸方面-便祕、腹瀉、感覺腹部脹大或噁心;過敏方面:皮疹;肝臟方面:AST (GOT)、ALT (GPT)、ALP、LDH或-GTP濃度上升;其他:水腫或嗜酸性白血球增多症。
輔助根除幽門螺旋桿菌臨床試驗觀察到之不良反應:胃腸方面-腹瀉、味覺異常、口腔炎、感覺腹部不適,或感覺腹部腫脹;過敏方面:皮疹;肝臟方面:AST (GOT)、ALT (GPT)濃度上升。
仿單版本:JP201903TW01
<詳細內容請參閱本品核定仿單>

